الكيمياء الصف الأول الثانوي
الكيمياء الصف الأول الثانوي التيرم الثاني تقدم منصة النموذج شرح مادة الكيمياء للصف الأول الثانوي التيرم الثاني
ومحتويات المنهج /الكيمياء -الكيمياء الحرارية -الطاقة -حرارة(الذوبان ..التخفيف…التكوين )-قانون هس -الاحتباس الحراري .
مفهوم الكيمياء
تُعرَّف الكيمياء بأنّها فرع العلوم الذي يهتم بدراسة خصائص المواد، وتكوينها، وبنيتها الكيميائية،
بالإضافة إلى دراسة التفاعلات والتحولات الكيميائية التي تمر بها لإنتاج مواد جديدة،
والطاقة التي تُصدرها أو تمتصّها أثناء ذلك، فجميع المواد الموجودة سواء كانت طبيعية أو اصطناعية تتكوّن من ذرة أو أكثر،
وكل ذرة تنفرد عن الأخرى بخصائص معينة وتُسمّى بالعنصر، والتي بدورها تتكون من أجسام تحت ذرية أصغر تُمثّل وحدات البناء الأساسية لها.
أنواع الكيمياء
يتفرّع علم الكيمياء إلى 5 فروع رئيسية، وعليه يُوضّح كل فرع منها كما يأتي:
الكيمياء التحليلية:

تُركّز الكيمياء التحليلية على فصل، وتصنيف، وتعريف المواد، ودراسة تركيبها الكيميائي عبر استخدام الأساليب النوعية بما فيها ملاحظة اختلاف الألوان،
والأساليب الكمية؛ كحساب الطول الموجي للضوء الذي يمتصه العنصر أثناء التغير اللوني.
الكيمياء الحيوية:
تستخدم الكيمياء الحيوية تقنيات الكيمياء لفهم طبيعة عمل الأنظمة البيولوجية على المستوى الكيميائي،
أيّ من أجل دراسة العمليات الكيميائية في أجسام الكائنات الحية،
وعليه فإنّ دراسة الجينوم البشري والخريطة الجينية،
وفهم تأثير البروتينات المختلفة على الجسم، واكتشاف علاجات للعديد من الأمراض تمّت من خلال الكيمياء الحيوية.الكيمياء غير العضوية:
تختصّ الكيمياء غير العضوية بدراسة الروابط الكيميائية في المواد غير العضوية والكائنات غير الحية، مثل: المعادن والصخور، ممّا يعني أنّها تهتم بدراسة المواد التي لا تحتوي على سلاسل الكربون والهيدروجين.الكيمياء الفيزيائية:
تختص الكيمياء الفيزيائية باستخدام المفاهيم الفيزيائية لفهم العمليات الكيميائية،
أي أنّها تُطبّق الفيزياء على دراسة الكيمياء كما هو الحال عند دراسة كيفية تحرك الذرات
وتفاعلها وسبب تحول بعض السوائل؛ كتحول الماء من الحالة السائلة إلى الغازية عند رفع درجة الحرارة،
فضلاً عن الاهتمام بدراسة الخصائص الذرية والميكروية للنظام الكيميائي المتمثلة بحساب معدل سرعة التفاعل،
والبنية الفيزيائية للعناصر الكيميائية على المستوى الذري والجزيئي، وتحولات الطاقة أثناء التفاعلات، وغير ذلك.
مصطلحات أساسية في الكيمياء
توضّح بعض المصطلحات الأساسية في علوم الكيمياء كما يأتي:
الذرة:

(بالإنجليزية: Atom)؛ وهي أصغر جزء في العنصر الكيميائي يمكن الحصول عليه،
وتتوفر أحياناً بشكل نقي أو مرتبطة بعناصر كيميائية أخرى على شكل مركباتٍ كيميائية.
العدد الذري:
(بالإنجليزية: Atomic Number)؛ ويُساوي عدد البروتونات في نواة الذرة.
الكتلة الذرية:
(بالإنجليزية: Atomic Mass)؛ وتُشير إلى كتلة الذرة بالوحدة التي تُعرف بوحدة كتل ذرية (amu)، وتُساوي العدد الإجمالي للنيوترونات والبروتونات في النواة.
الحمض:
(بالإنجليزية: Acid)؛ وهو أي مادة تميل لكسب الإلكترونات عوضاً عن فقدها، وتتأين في المحاليل على شكل أيونات موجبة، ومن الجدير بالذكر أنّها تُكوّن محاليل درجة حموضتها (PH) أقل من 7.
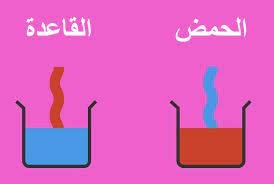
القاعدة:
(بالإنجليزية: Base)؛ وهي أيّ مركب كيميائي يحتوي على أيون الهيدروكسيد السالب (HO-)، أي أنّها مادة تميل لفقد الإلكترونات عوضاً عن كسبها،
حيث تمنح زوجاً من الإلكترونات في الروابط التساهمية مع الحموض، وتكون درجة حموضة محاليلها أعلى من 7.
المركب:
(بالإنجليزية: Compound)؛ وهو ناتج ترابط وتفاعل عنصرين أو أكثر معاً، بحيث تكون خصائص المركب مختلفة عن خصائص العناصر المكونة له.
العنصر:
(بالإنجليزية: Element)؛ وهو مادة لا يُمكن فصلها إلى مادتين أو أكثر، حيث تتكون من ذرات لها نفس العدد الذري.
الجزيء:
(بالإنجليزية: Molcule)؛ وهو أصغر وحدة هيكلية في المادة الكيميائية النقية، ويتكوّن من ذرة واحدة أو أكثر، ويحمل نفس خصائص وسلوك العنصر المكوِّن لها.
تعريف الديناميكا الحرارية
تدرس الديناميكا الحرارية (بالإنجليزية: Thermodynamics) العلاقة بين الحرارة والشغل وأشكال الطاقة الأخرى، وتُعنى بشكل خاص بوصف كيفية تحوّل الطاقة الحرارية من وإلى شكل آخر من الطاقة،
كما تدرس كيفية تأثير الطاقة الحرارية على المادة، ويُمكن تعريفها على أنّها الطاقة التي تمتلكها المادة أو النظام بفعل درجة الحرارة، فهي طاقة الجزيئات المتحركة أو الإهتزازية للمادة.
فروع الديناميكا الحرارية
تتفرّع الديناميكا الحرارية إلى 4 فروع رئيسية، وهي كالآتي:
الديناميكا الحرارية الكلاسيكية:
(بالإنجليزية: Classical Thermodynamics) وفيها يُحلّل سلوك المواد من خلال نهج مجهري مخبري، إذ تؤخذ الظروف مثل درجة الحرارة والضغط في الاعتبار، الأمر الذي يُساعد الفرد على التجربة،
إذ من الممكن من حساب خصائص المادة الأخرى وقياسها بطريقة صحيحة ودقيقة.
الديناميكا الحرارية الإحصائية:
(بالإنجليزية: Statistical Thermodynamics) يُعنى هذا الفرع بفحص كلّ جزيء من جزيئات المادة بدقة وبشكل منفصل، حيث يُركّز على دراسة خصائص كلّ جزيء،
والطرق التي تتفاعل فيها الجزيئات مع بعضها البعض، وذلك لمعرفة سلوك مجموعة من الجزيئات.
الديناميكا الحرارية الكيميائية:
(بالإنجليزية: Chemical Thermodynamics) وتعني دراسة العلاقات المختلفة بين الشغل المنجز والحرارة، حيث تدرس ترابطهما في التفاعلات الكيميائية وعند تغيّر حالة المواد.
الديناميكا الحرارية للتوازن:
(بالإنجليزية: Equilibrium Thermodynamics) تدرس هذه الديناميكا الحرارية تحوّلات الطاقة والمادة عندما تقترب من حالة التوازن.
ما هو الاحتباس الحراري

تعرّف ظاهرة الاحتباس الحراري، أو ظاهرة الاحترار العالمي
(بالإنجيزيّة: Global Warming) أو ظاهرة الدفيئة (بالإنجليزية: Greenhouse)،على أنّها ارتفاع في معدّل درجة حرارة الهواء الجوّي الموجود في الطبقة السفلى من سطح الأرض، وذلك خلال القرن أو القرنين الماضيين.
وتحدث هذه الظاهرة عند حبس أو احتباس حرارة الشمس في الغلاف الجوي للأرض بعد دخولها إليه، ممّا يرفع درجة حرارة الأرض ويجعلها أكثر دفئاً،
ويتم ذلك من خلال امتصاص غازات الغلاف الجوي كثاني أكسيد الكربون لطاقة الشمس وحبسها بالقرب من الأرض ممّا يساهم في ارتفاع حرارة الأرض.
أسباب الاحتباس الحراري
العوامل البشري – العوامل الطبيعية – البراكين – النشاط الشمسي
العوامل البشرية
تساهم الأنشطة البشريّة في تغيير المناخ بشكلٍ واضحٍ من خلال استخدام الإنسان للوقود الأحفوري بأشكاله المختلفة في أنشطته،
إذ إنّ احتراق الوقود الأحفوري يؤدي إلى انبعاث الغازات الدفيئة كغاز ثاني أكسيد الكربون في الجو،
ممّا يؤدي إلى إحداث تغيير في الغلاف الجويّ مثل كميّة الهباء الجوي “جزيئات عالقة في الهواء” والغيوم.
العوامل الطبيعية
تعتبر ظاهرة الاحتباس الحراري ظاهرة معقدة؛ فهي ناتجة عن التفاعل بين الأسباب البشريّة مع مجموعةٍ من العوامل الطبيعيّة،
ويعد الارتفاع في متوسط درجة الحرارة في الوقت الحاضر ناتجاً عن التفاعل بينهما،
البراكين
تعتبر البراكين أحد العوامل التي تُساهم في تشكيل ظاهرة الاحتباس الحراري، حيث إنّ حدوث ثوران البراكين على مدى ملايين السنين
أدّى إلى انبعاث كميّاتٍ كبيرةٍ من الغازات الدفيئة في الجو، كبخارالماء وثاني أكسيد الكربون.
النشاط الشمسي
تؤثر التغيُّرات الحاصلة في النشاط الشمسي والأنشطة المرتبطة به كالتوهجات والبقع الشمسيّة في تغير درجة الحرارة العالميّة، ومثال ذلك،
تميّز القرن السابع عشر بفترةٍ مناخيّةٍ تسمى العصر الجليديّ الصغير، والذي تمّ تفسير تشكّله في ذلك الوقت بأنّ نشاط الشمس القليل، وأشعتها خافتة،
إذ كانت متوسط درجة الحرارة العالميّة أقل بنحو درجة مئويةٍ واحدة مما هو عليه الآن.
قانون هس في الكيمياء
الكيمياء الصف الأول الثانوي
قانون هس في الكيمياء
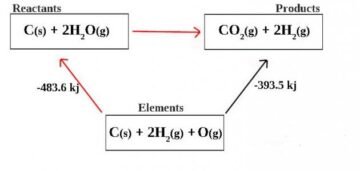
يعبّر قانون هس في الكيمياء عن القانون الذي يصف أنّ التغيّر في الطاقة في التفاعل الكيميائيّ الكليّ يساوي مجموع التغيّر في الطّاقة في كل طرف من أطراف التفاعل الكيميائيّ.
اكتشاف قانون هس
نشر قانون هس لمجموع الحرارة من قِبل العالم الكيميائيّ السويديّ جيرمان هنري هس المولود في عام 1840م،
نصّ على أنّ الحرارة الممتصّة أو المتحوّلة في أي تفاعلٍ كيميائيٍّ هي قيمة ثابتة ومستقلة في مسار التفاعل الكيميائيّ، أو في المراحل التي أُجريت للحصول على التفاعل،
ولكن لا يعتبر قانون هس قانوناً حرارياً منفصلاً وذلك لأنّه نتيجةً للقانون الأول في الديناميكا الحراريّة،
وعلى الرغم من ذلك فقد حافظ على هويته بسبب أهميّته كأساس حساب درجات الحرارة في التفاعل الكيميائيّ.
شرح قانون هس
ساهم قانون هس والذي يسمّى أيضاً بقانون حفظ الطّاقة في تسهيل كتابة المعادلة الكيميائيّة، بالإضافة إلى تبسيط عمليّة تحديد قيمة التغيّر في الطاقة الداخليّة الكامنة الكليّة؛
حيث إنّ الطاقة الكامنة الداخلية الكليّة هي كميّة الطاقة أو الحرارة في المركّب تحت ضغطٍ معيّن،
والتغيّر في هذه الطاقة هو مقدار تغيّر الطاقة الكامنة الكليّة للمواد المشاركة في التفاعل لتكوين المنتجات،
ويعبّر عن القيمة بالإشارة السالبة في حالة انبعاث الطّاقة، والموجبة في حالة استهلاك الطاقة،
حيث حدد القانون أنّ الطاقة الداخليّة الكليّة تساوي مجموع الطاقة في كل طرف من أطراف التفاعل بغض النظر عن الخطوات المختلفة، والوسائط المُستخدمة في التفاعل،
وبالتالي فإنّه من الممكن تحديد التغيّر الكلي للطاقة الداخليّة من المعادلة المقسّمة على شكل: (أ+ب+ج= أ* ب*ج) عن طريق معرفة قيمة التغيّر في طاقة التفاعل،
كما يمكن حساب التغيّر في قيمة الطاقة الداخليّة للمعادلة: (أ+ب=أب و أب+ج=أ*ب*ج) ثمّ جمعهما معاً.

